DOMMAGES CELLULAIRES ET ROS
Les dommages cellulaires sont induits par les espèces à oxygène réactif (ROS). Les ROS sont des radicaux libres, des anions réactifs contenant des atomes d'oxygène ou des molécules contenant de l'oxygène capables de générer des radicaux libres. Le radical hydroxyle, le superoxyde et le peroxyde d'hydrogène en sont des exemples.
La principale source de ROS in vivo est la respiration aérobie, mais les ROS sont également produits lors de la bêta-oxydation des acides gras, dans le métabolisme des composés xénobiotiques par le cytochrome P450, dans la stimulation de la phagocytose des agents pathogènes ou des lipopolysaccharides, etc. Les ROS et le stress oxydatif en général sont impliqués dans certaines maladies chroniques telles que la maladie d'Alzheimer et de Parkinson, le cancer et le vieillissement.



LE RADICAL SUPEROXYDE
En partant d'une molécule d'O2 et en ajoutant un électron à l'orbite externe, on obtient le produit de réduction de l'oxygène moléculaire : l'anion superoxyde (O2.- ). Il est produit lors de la phosphorylation oxydative, par des enzymes (c'est-à-dire la xanthine oxydase) et des leucocytes. En raison de sa toxicité, tous les organismes aérobies ont développé différentes isoformes de l'enzyme antagoniste : la superoxyde dismutase (SOD). La SOD est une enzyme très efficace, capable de combiner l'anion superoxyde avec deux H+, catalysant la réaction de dismutation par l'intermédiaire d'un cofacteur à base de métal, ce qui donne H2O2 et O2 comme produits finaux. S'il n'est pas correctement et rapidement inactivé, l'anion superoxyde peut endommager les lipides, les protéines et l'ADN des membranes.
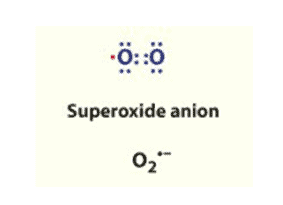

L'INACTIVATION ENZYMATIQUE DU SUPEROXYDE
Dans des conditions normales, dans notre corps, les ROS sont inactivés par des enzymes telles que la superoxyde dismutase (SOD), la catalase (CAT) et la glutathion peroxydase (GPx). La SOD est une enzyme clé capable d'inactiver le radical superoxyde, l'une des espèces de radicaux les plus réactives et donc les plus dangereuses.
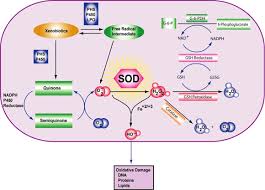
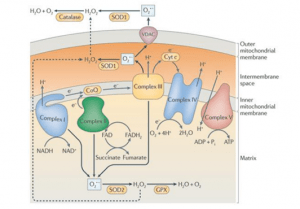
LE SUPEROXYDE DISMUTASE ENZIME
Pour réduire les effets nocifs des ROS, les cellules ont développé différentes stratégies de défense, y compris des systèmes enzymatiques et non enzymatiques. En ce qui concerne les enzymes antioxydantes, certaines d'entre elles jouent un rôle préventif en éliminant directement les ROS. Parmi ces enzymes, la superoxyde dismutase est la première ligne de défense qui élimine l'anion superoxyde, le premier et le plus réactif des radicaux dérivés de l'oxygène moléculaire. La SOD est donc l'un des principaux systèmes de défense antioxydants présents dans presque toutes les cellules exposées à l'oxygène. La réaction catalysée par la SOD est une dismutation avec une cinétique de second ordre basée sur les demi-réactions suivantes :
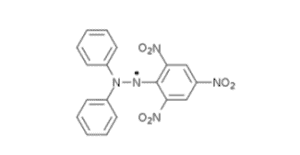
Méthode DPPH
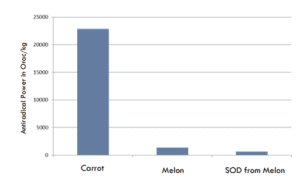
La capacité antiradicalaire a été évaluée à l'aide de la méthode DPPH. L'échantillon est placé dans une solution concentrée d'un radical libre standard (1,1-diphényl-2-picryl-hydrazyl) et sa concentration est mesurée par spectrophotométrie pour évaluer la capacité du phytocomplexe à éteindre les radicaux. Le Superox-D a une capacité antiradicalaire élevée grâce à des mécanismes d'extinction.
16 fois plus anti-radicalaire que le melon
37 fois plus antiradicalaire que le SOD du melon

RÉFÉRENCES
Doddigarla Z Corrélation des taux sériques de chrome, zinc, magnésium et SOD avec l'HbA1c dans le diabète de type 2 : Une analyse transversale. Syndrome métabolique du diabète. 2016 janv-Mar;10(1 Suppl 1):S126-9. doi : 10.1.
Vouldoukis I, Conti M, Krauss P, et al. Une supplémentation en extrait de superoxyde dismutase végétale combinée à la gliadine favorise les défenses antioxydantes et protège contre le stress oxydatif. Phytother Res. 2004 Dec;18(12):957-62.
Vouldoukis I, Lacan D, Kamate C, et al. Propriétés antioxydantes et anti-inflammatoires d'un extrait de Cucumis melo LC. riche en activité superoxyde dismutase. J Ethnopharmacol. 2004 Sep;94(1):67-75.
Muth CM, Glenz Y, Klaus M, et al. Influence of an orally effective SOD on hyperbaric oxygen-related cell damage. Free Radic Res. 2004 Sep;38(9):927-32.
Barouki R. Vieillissement des radicaux libres et stress cellulaire. Med Sci (Paris). 2006 Mar;22(3):266-72.
Faraci FM, Didion SP. Protection vasculaire : isoformes de superoxyde dismutase dans la paroi des vaisseaux. Arterioscler Thromb Vasc Biol. 2004 Aug;24(8):1367-73.
Fukai T, Folz RJ, Landmesser U, Harrison DG. Superoxyde dismutase extracellulaire et maladies cardiovasculaires. Cardiovasc Res. 2002 Aug 1;55(2):239-49.
Petersen SV, Oury TD, Ostergaard L, et al. La superoxyde dismutase extracellulaire (EC-SOD) se lie au collagène de type i et protège contre la fragmentation oxydative. J Biol Chem. 2004 Apr 2;279(14):13705-10.
Maier CM, Chan PH. Rôle des superoxydes dismutases dans les dommages oxydatifs et les troubles neurodégénératifs. Neuroscientifique. 2002 Aug;8(4):323-34.
Fattman CL, Schaefer LM, Oury TD. La superoxyde dismutase extracellulaire en biologie et en médecine. Free Radic Biol Med. 2003 Aug 1;35(3):236-56.
Chung JM. Le rôle des espèces réactives de l'oxygène (ROS) dans la douleur persistante. Mol Interv. 2004 Oct;4(5):248-50.
Bae SC, Kim SJ, Sung MK. Apport insuffisant de nutriments antioxydants et altération du statut antioxydant du plasma des patients atteints de polyarthrite rhumatoïde. J Am Coll Nutr. 2003 Aug;22(4):311-5.
Zawadzka-Bartczak E. Activités des enzymes antioxydantes des globules rouges (SOD, GPx) et capacité antioxydante totale du sérum (TAS) chez les hommes atteints d'athérosclérose coronaire et chez les pilotes sains. Med Sci Monit. 2005 Sep;11(9):CR440-4.
Gow A, Ischiropoulos H. Super-SOD : la chimère superoxyde dismutase combat l'inflammation. Am J Physiol Lung Cell Mol Physiol. 2003 Jun;284(6):L915-6.
Flohe L. Superoxyde dismutase à usage thérapeutique : expérience clinique, impasses et espoirs. Mol Cell Biochem. 1988 Dec;84(2):123-31.
Carlo MD, Jr., Loeser RF. L'augmentation du stress oxydatif avec le vieillissement réduit la survie des chondrocytes : corrélation avec les niveaux de glutathion intracellulaire. Arthrite rhumatoïde. 2003 Dec;48(12):3419-30.
Junqueira VB, Barros SB, Chan SS, et al. Vieillissement et stress oxydatif. Mol Aspects Med. 2004 Feb;25(1-2):5-16.
Vina J, Lloret A, Orti R, Alonso D. Molecular bases of the treatment of Alzheimer's disease with antioxidants : prevention of oxidative stress. Mol Aspects Med. 2004 Feb;25(1-2):117-23.
Okada F, Shionoya H, Kobayashi M, et al. Prevention of inflammation-mediated acquisition of metastatic properties of benign mouse fibrosarcoma cells by administration of an orally available SOD. Br J Cancer. 2006 Mar 27;94(6):854-62.
Benedetti S, Lamorgese A, Piersantelli M, Pagliarani S, Benvenuti F, Canestrari F. Stress oxydatif et statut antioxydant chez les patients subissant une exposition prolongée à l'oxygène hyperbare. Clin Biochem. 2004 Apr;37(4):312-7.
Dennog C, Radermacher P, Barnett YA, Speit G. État des antioxydants chez l'homme après exposition à l'oxygène hyperbare. Mutat Res. 1999 Jul 16;428(1-2):83-9.
Levin ED. La superoxyde dismutase extracellulaire (EC-SOD) éteint les radicaux libres et atténue le déclin cognitif lié à l'âge : opportunités pour le développement de nouveaux médicaments dans le domaine du vieillissement. Curr Alzheimer Res. 2005 Apr;2(2):191-6. R

