Fatti sulle dismutasi di superossido: Rivelato il ruolo nella segnalazione Redox
Le SOD rappresentano il primo sistema di difesa enzimatica contro i danni radicali da ossigeno: questo enzima è quindi essenziale per tutti gli organismi aerobici, ma non per gli anaerobi. A sostegno di questa ipotesi, McCord ha ritenuto che l'esistenza di un organismo aerobico dipenda principalmente dalla sua capacità di produrre SOD, poiché la sua carenza è responsabile della sensibilità all'ossigeno e consente la sopravvivenza solo in ambiente anaerobico.
In condizioni fisiologiche, il superossido dismutasi, insieme con i non enzimatici ROS scavengers come le vitamine E, A e C mantengono uno stato costante tra sistemi ossidanti e antiossidanti (Russo et al., 2011). La disregolazione nell'omeostasi redox, determinata da uno squilibrio tra la produzione di ROS e la capacità di scavenging, determina un notevole danno cellulare come la lipoperossidazione della membrana, l'acido nucleico e le alterazioni strutturali delle proteine che contribuiscono alle malattie neurodegenerative e cardiovascolari.
Negli ultimi anni, molti dati ottenuti in studi in vitro eseguiti in molte linee cellulari, soprattutto neuroblastoma SK-N-BE cellule, indicano che SOD1 è secreto ed è in grado di attivare, attraverso il recettore muscarinico M1, le vie cellulari che coinvolgono l'attivazione ERK1/2 e AKT, questi effetti sono associati con l'aumento intracellulare di calcio che è ulteriormente accentuato quando queste cellule sono stimolate con SOD1G93A mutato.
La localizzazione intracellulare citosolica SOD1 è stata oggetto di dibattito; recenti evidenze, eseguite in cellule di neuroblastoma neuro2 di topo trasfettato, hanno dimostrato che sia i mutanti di tipo selvatico SOD1 (wt-SOD1) che quelli di SOD1 sono distribuiti nelle strutture luminali dell'apparato endoplasmatico e Golgi (Urushitani et al., 2008). Le prime prove sperimentali che alcune linee cellulari potrebbero essere in grado di secernere la Cu,Zn superossido dismutasi risalgono a molti anni fa quando, per la prima volta, abbiamo mostrato la secrezione di questa proteina attraverso esperimenti eseguiti su epatociti e fibroblasti (Mondola et al., 1996), cellule SK-N-BE del neuroblastoma (Mondola et al., 1998; Gomes et al., 2007; Polazzi et al., 2013) e in cellule epiteliali derivate dal timo (Cimini et al., 2002).
Inoltre, abbiamo dimostrato che nelle cellule umane di neuroblastoma SK-N-BE, che mostrano una maggiore sensibilità alla citotossicità indotta dalla privazione di glucosio dovuta alla maggiore sensibilità al ROS (Shutt et al., 2010), l'esportazione di SOD1 avviene in condizioni normali ed è aumentata a seguito di stress ossidativo (Mondola et al., 1996, 1998). Successivamente, abbiamo dimostrato che la SOD1 nelle cellule SK-N-BE del neuroblastoma umano viene esportata attraverso una via secretoria microvescicolare compromessa dalla brefeldina-A (BFA), e dal 2-deossiglucosio, e dall'azoturo di sodio, che riduce il pool intracellulare di ATP (Mondola et al., 2003).
Indicatori sul ruolo della superossido di manganese dismutasi in ... - Hindawi devi sapere
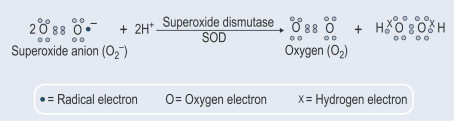

Un altro aspetto importante è stata la scoperta che oltre alla costitutiva esportazione di SOD1, la secrezione di questo enzima è anche indotta. A questo proposito, abbiamo dimostrato (Santillo et al., 2007) che la SOD1 è attivamente rilasciata dai sinaptosomi cerebrali di ratto così come dalle cellule GH3 dell'ipofisi di ratto che rappresentano un buon modello per studiare il rilascio inducibile della SOD1 in quanto possiedono tutte le macchine proteiche neuronali coinvolte nell'esocitosi delle vescicole sinaptiche.
Inoltre, nel tentativo di valutare il possibile ruolo svolto dall'esportazione di SOD1, abbiamo recentemente dimostrato, nella linea cellulare del neuroblastoma SK-N-BE, che questo enzima è in grado, attraverso il coinvolgimento del recettore muscarinico M1, di attivare ERK1/2 e AKT in modo dipendente dalla dose e dal tempo. Questo effetto è stato notevolmente ridotto dal silenziamento del recettore M1 e dall'utilizzo di pirenzepina antagonista M1 (Damiano et al., 2013).
Tuttavia, FGF-1 e l'isoforma 18 kDa di FGF-2 hanno dimostrato di essere secreti da un percorso alternativo che viene direttamente traslocato dal citoplasma nello spazio extracellulare. Analogamente, anche l'interleuchina 1β (IL-1β) è stata segnalata come secreta da una via di esportazione vescicolare non classica. Le proteine solubili contengono classicamente peptidi di segnale N-terminale che li dirigono verso l'apparato di traslocazione del Reticolo Endoplasmatico (ER) (Walter et al., 1984).
Inoltre, la secrezione di proteine non classiche dipende sia dall'energia che dalla temperatura e può essere stimolata o inibita da vari trattamenti (Cleves, 1997; Hughes, 1999). L'elenco delle proteine che potrebbero essere esportate dalle cellule in assenza di un sistema funzionale ERG (via di secrezione non convenzionale), come IL-1β e galectina-1 (indicato anche come L-14), è in continua crescita; per ulteriori dati si veda la revisione del Nickel (2003).

Per questo motivo la secrezione di SOD1 dovrebbe bypassare il canonico percorso di secrezione di ERG. Abbiamo precedentemente dimostrato che il BFA, così come il 2-deossiglucosio e l'azoturo di sodio (NaN3), compromettono l'esportazione della SOD1 (Mondola et al., 2003). A nostro parere, il trattamento con BFA probabilmente disregola non solo la classica via secretoria ERG ma anche il traffico microvescicolare a membrana di secrezione proteica non convenzionale o l'esportazione di proteine alternative.
Il trucco di 20 secondi per la superossido dismutasi: benefici per la salute, usi, effetti collaterali ...
Inoltre, questi autori hanno dimostrato che SOD1A4V inibisce il trasporto delle proteine secretorie dal pronto soccorso all'apparato Golgi. La sclerosi laterale amiotrofica (SLA) è una malattia neurodegenerativa ad insorgenza adulta caratterizzata dalla morte selettiva dei motoneuroni superiori e inferiori del cervello e del midollo spinale. I sintomi includono atrofia muscolare, spasticità, paralisi e morte per insufficienza respiratoria entro 3-5 anni dalla diagnosi.
I processi clinici e patologici indicano che lo stress da pronto soccorso rappresenta un percorso chiave nella morte cellulare. Nel modello transgenico SOD1G93A ALS di ratto è stata osservata una risposta proteica dispiegata e un'apoptosi ER indotta dallo stress (Atkin et al., 2006); una risposta proteica dispiegata, che include l'induzione di chinasi da sensori di stress, chaperon e mediatori apoptotici, è stata mostrata anche nei motoneuroni del midollo spinale di pazienti umani con la forma sporadica della SLA (sALS) che non è limitata alle mutazioni della SOD1 (Atkin et al., 2008).
SOD1 e altre proteine sono erroneamente ripiegate in fALS e in sALS, ma non è chiaro come questo inneschi stress ER, frammentazione dell'apparato Golgi, interruzione del trasporto assonale e apoptosi. Quasi 20% di fALS è causato da mutazioni del gene SOD1 (Neumann et al., 2006). Infatti, la maggior parte dei mutanti SOD1 mantengono la loro attività enzimatica suggerendo il verificarsi di un guadagno della funzione di attività tossica piuttosto che una semplice perdita di funzione (Strong et al., 2005; Dion et al., 2009).
(2005) ha dimostrato una compromessa secrezione costitutiva extracellulare di SOD1 mutante in NSC-34 cellule che induce frequenti inclusioni citoplasmatiche e insolubilità proteica. Questi dati collegano la secrezione carente di SOD1 mutante con gli aggregati proteici intracellulari e la tossicità nelle cellule NSC-34. Inoltre, questi autori hanno dimostrato che in un modello transgenico di ratto della SLA l'infusione cronica intraspinale di un umano esogeno wt-SOD1 ritarda significativamente la progressione della malattia, suggerendo un nuovo ruolo extracellulare per la SOD1 nella SLA; quindi la consegna extracellulare di wt-SOD1 umana potrebbe migliorare la malattia clinica nei ratti transgenici SLA che sostengono un nuovo ruolo extracellulare per il mutante e wt-SOD1 nella patogenesi della SLA e nella terapia, rispettivamente.
Inoltre, nei topi transgenici, portatori di mutazioni della SOD1, sono stati osservati effetti tossici per i motoneuroni attraverso l'attivazione della microglia (Urushitani et al., 2006; Zhao et al., 2010). Le cellule della microglia possono svolgere un ruolo importante nella progressione della SLA (Pramatarova et al., 2001) poiché l'attivazione della microglia può essere osservata prima della perdita di neuroni in topi transgenici che esprimono mutanti SOD1 umani (Alexianu et al., 2001).


Grazie per aver condiviso le vostre informazioni. Apprezzo molto i vostri sforzi e attendo i vostri ulteriori ringraziamenti per la scrittura ancora una volta. Tandie Lazarus Hughes