Datos sobre las dismutasas de superóxido: Se revela el papel en la señalización de los redox
Los SOD representan el primer sistema de defensa enzimática contra el daño radical por el oxígeno: por lo tanto, esta enzima es esencial para todos los organismos aeróbicos, pero no para los anaerobios. Para apoyar esta hipótesis, McCord creía que la existencia de un organismo aeróbico depende principalmente de su capacidad para producir SODs, ya que su deficiencia es responsable de la sensibilidad al oxígeno y permite la supervivencia sólo en un ambiente anaeróbico.
En condiciones fisiológicas, las superóxidos dismutasas, junto con los secuestradores de ROS no enzimáticos como las vitaminas E, A y C, mantienen un estado estable entre los sistemas oxidantes y antioxidantes (Russo et al., 2011). La desregulación en la homeostasis redox, determinada por un desequilibrio entre la producción de ROS y la capacidad de eliminación de residuos, determina un daño celular considerable como la lipoperoxidación de la membrana, el ácido nucleico y las alteraciones estructurales de las proteínas que contribuyen a las enfermedades neurodegenerativas y cardiovasculares.
En los últimos años, muchos datos obtenidos en estudios in vitro realizados en muchas líneas celulares, principalmente en células de neuroblastoma SK-N-BE, indican que la SOD1 es secretada y es capaz de activar, a través del receptor muscarínico M1, vías celulares que implican la activación de ERK1/2 y AKT; estos efectos se asocian con el aumento del calcio intracelular que se acentúa aún más cuando estas células son estimuladas con SOD1G93A mutado.
La localización citosólica intracelular de SOD1 ha sido objeto de debate; pruebas recientes, realizadas en células neuroblastoma neuro2 de ratones transfectadas, demostraron que tanto el tipo salvaje de SOD1 (wt-SOD1) como los mutantes de SOD1 se distribuyen en estructuras lumínicas del aparato endoplásmico y de Golgi (Urushitani et al., 2008). Las primeras pruebas experimentales de que algunas líneas celulares podrían ser capaces de secretar la superóxido dismutasa de Cu,Zn se remontan a muchos años atrás cuando, por primera vez, mostramos la secreción de esta proteína mediante experimentos realizados en hepatocitos y fibroblastos (Mondola et al., 1996), en células de neuroblastoma SK-N-BE (Mondola et al., 1998; Gomes et al., 2007; Polazzi et al., 2013) y en células epiteliales derivadas del timo (Cimini et al., 2002).
Además, demostramos que en las células del neuroblastoma humano SK-N-BE, que muestran una mayor sensibilidad a la citotoxicidad inducida por la privación de glucosa debido a una mayor sensibilidad a la ROS (Shutt et al., 2010), la exportación de SOD1 tiene lugar en condiciones normales y aumenta tras el estrés oxidativo (Mondola et al., 1996, 1998). Sucesivamente, demostramos que la SOD1 en las células del neuroblastoma humano SK-N-BE se exporta a través de una vía secretoria microvesicular que se ve afectada por la brefeldina-A (BFA), y por la 2-deoxiglucosa, y la azida de sodio, que reduce el pool intracelular de ATP (Mondola et al., 2003).
Indicadores sobre el papel de la superóxido de manganeso dismutasa en ... - Hindawi Necesitas saber
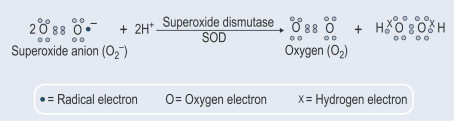

Otro aspecto importante fue el descubrimiento de que además de la exportación constitutiva de SOD1, también se induce la secreción de esta enzima. A este respecto, demostramos (Santillo et al., 2007) que la SOD1 es liberada activamente de los sinaptosomas del cerebro de las ratas así como de las células GH3 de la pituitaria de las ratas que representan un buen modelo para estudiar la liberación inducible de SOD1 ya que poseen toda la maquinaria proteica neuronal involucrada en la exocitosis de la vesícula sináptica.
Además, en el intento de evaluar el posible papel que desempeña la exportación de SOD1, recientemente demostramos, en la línea celular del neuroblastoma SK-N-BE, que esta enzima es capaz, gracias a la participación del receptor muscarínico M1, de activar el ERK1/2 y el AKT de forma dosis y dependiente del tiempo. Este efecto se redujo notablemente mediante el silenciamiento del receptor M1, así como mediante el uso del antagonista de la pirenzepina M1 (Damiano et al., 2013).
Sin embargo, se ha demostrado que el FGF-1 y la isoforma de 18 kDa del FGF-2 son secretados por una vía alternativa que se traslada directamente del citoplasma al espacio extracelular. Análogamente, también se ha informado de que la interleucina 1β (IL-1β) es secretada por una vía de exportación vesicular no clásica. Las proteínas solubles contienen clásicamente péptidos de señal N-terminal que las dirigen al aparato de translocación del retículo endoplásmico (ER) (Walter et al., 1984).
Además, la secreción proteínica no clásica depende tanto de la energía como de la temperatura y puede ser estimulada o inhibida por diversos tratamientos (Cleves, 1997; Hughes, 1999). La lista de proteínas que podrían exportarse de las células en ausencia de un sistema funcional de ERG (vía secretoria no convencional), como la IL-1β y la galectina-1 (también denominada L-14), crece continuamente; para más datos véase el examen de Níquel (2003).

Por esta razón, la secreción de SOD1 debería evitar la vía secretoria canónica del ERG. Ya demostramos anteriormente que los BFA, así como la 2-deoxiglucosa y la azida sódica (NaN3), perjudican la exportación de SOD1 (Mondola et al., 2003). En nuestra opinión, el tratamiento con BFA probablemente desregula no sólo la vía secretoria clásica del ERG sino también el tráfico de la membrana microvesicular de la secreción proteínica no convencional o la exportación de proteínas alternativas.
El truco de 20 segundos para la superóxido dismutasa: Beneficios para la salud, usos, efectos secundarios...
Además, estos autores mostraron que el SOD1A4V inhibe el transporte de proteínas secretas desde el RE al aparato de Golgi. La esclerosis lateral amiotrófica (ELA) es una enfermedad neurodegenerativa de inicio en la edad adulta, caracterizada por la muerte selectiva de las motoneuronas superiores e inferiores del cerebro y la médula espinal. Los síntomas incluyen atrofia muscular, espasticidad, parálisis y eventual muerte por insuficiencia respiratoria dentro de los 3-5 años siguientes al diagnóstico.
Los procesos clínicos y patológicos indican que el estrés de la sala de emergencias representa una vía clave involucrada en la muerte celular. En el modelo de rata transgénica SOD1G93A ALS se desplegó la respuesta proteínica y se ha observado apoptosis inducida por el estrés del RE (Atkin et al., 2006); también se ha demostrado una respuesta proteínica desplegada, que incluye la inducción de quinasas sensoras de estrés, chaperones y mediadores apoptóticos, en las motoneuronas de la médula espinal de pacientes humanos con la forma esporádica de ALS (sALS) que no está restringida a las mutaciones de SOD1 (Atkin et al., 2008).
El SOD1 y otras proteínas están mal plegadas en los fALS y en los sALS, pero no está claro cómo esto desencadena el estrés de ER, la fragmentación del aparato de Golgi, la interrupción del transporte axonal y la apoptosis. Cerca de 20% de los fALS es causado por las mutaciones del gen SOD1 (Neumann et al., 2006). De hecho, la mayoría de los mutantes SOD1 mantienen su actividad enzimática, lo que sugiere la aparición de una ganancia de función de actividad tóxica en lugar de una simple pérdida de función (Strong et al., 2005; Dion et al., 2009).
(2005) demostró un deterioro de la secreción extracelular constitutiva de la SOD1 mutante en las células NSC-34 que induce frecuentes inclusiones citoplasmáticas e insolubilidad de las proteínas. Estos datos vinculan la deficiente secreción de SOD1 mutante con los agregados de proteína intracelular y la toxicidad en las células NSC-34. Además, estos autores demostraron que en un modelo de rata transgénica de ELA la infusión intraespinal crónica de wt-SOD1 humana exógena retrasó significativamente la progresión de la enfermedad, lo que sugiere un nuevo papel extracelular para la SOD1 en la ELA; por lo tanto, la administración extracelular de wt-SOD1 humana podría mejorar la enfermedad clínica en ratas transgénicas de ELA, apoyando un nuevo papel extracelular para la SOD1 mutante y la wt-SOD1 en la patogénesis y la terapia de la ELA, respectivamente.
Además, en ratones transgénicos, portadores de mutaciones de SOD1, se observaron efectos tóxicos en las neuronas motoras por la activación de la microglia (Urushitani et al., 2006; Zhao et al., 2010). Las células de la microglia pueden desempeñar un papel importante en la progresión de la ELA (Pramatarova et al., 2001), ya que la activación de la microglia puede observarse antes de la pérdida de neuronas en los ratones transgénicos que expresan mutaciones de SOD1 en los humanos (Alexianu et al., 2001).


Gracias por compartir tu información. Aprecio mucho sus esfuerzos y estoy esperando que me lo agradezcan una vez más. Tandie Lazarus Hughes