Datos sobre la Superóxido Dismutasa (Ransod) - Reactivo - Randox Revelado
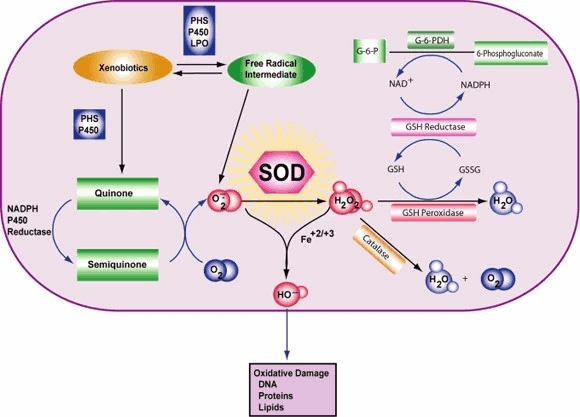
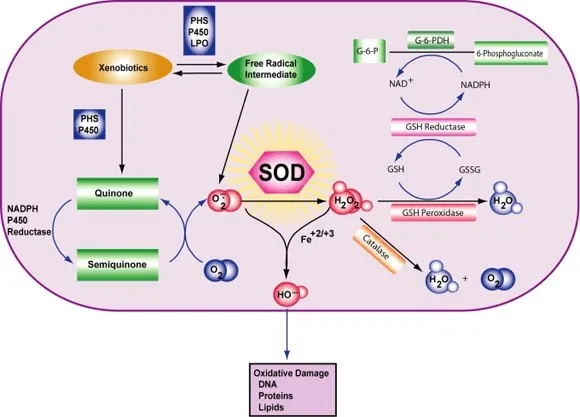
Clase de enzimas La superóxido dismutasa (SOD, EC 1.15.1.1) es una enzima que alternativamente cataliza la dismutación (o partición) del radical superóxido (O2-) en oxígeno molecular ordinario (O2) y peróxido de hidrógeno (H2O2). El superóxido se produce como un subproducto del metabolismo del oxígeno y, si no se regula, causa muchos tipos de daño celular.
Por lo tanto, la SOD es una defensa antioxidante importante en casi todas las células vivas expuestas al oxígeno. Una excepción son los lactobacilos relacionados, que usan un mecanismo diferente para prevenir el daño por el O2 reactivo. Los SOD catalizan la desproporción de superóxido: 2 HO2 → O2 + H2O2 De esta manera, el O2- se convierte en dos especies menos dañinas.
donde M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2). En una serie de reacciones de este tipo, el estado de oxidación y la carga del catión metalúrgico oscila entre n y n+1: +1 y +2 para el Cu, o +2 y +3 para los otros metales . Irwin Fridovich y Joe McCord, de la Universidad de Duke, descubrieron la actividad enzimática de la superóxido dismutasa en 1968.
El zumbido de la molécula del mes: Superóxido Dismutasa - Pdb-101
Asimismo, Brewer (1967) identificó una proteína que más tarde se conoció como superóxido dismutasa como una indofenol oxidasa mediante el análisis de la proteína de los geles de almidón utilizando la técnica de la fenazina-tetrazolio. Hay tres familias principales de superóxido dismutasa, según el pliegue de la proteína y el cofactor del metal: el tipo Cu/Zn (que se une tanto al cobre como al zinc), los tipos Fe y Mn (que se unen al hierro o al manganeso) y el tipo Ni (que se une al níquel).
Los citosoles de prácticamente todas las células eucarióticas contienen una enzima SOD con cobre y zinc (Cu-Zn-SOD). Por ejemplo, el Cu-Zn-SOD disponible en el mercado normalmente se purifica de los glóbulos rojos de los bovinos. La enzima bovina Cu-Zn es un homodímero de peso molecular 32.500. Fue la primera SOD cuya estructura cristalina de detalle atómico fue resuelta, en 1975.
Las dos subunidades están estrechamente unidas una detrás de otra, principalmente por interacciones hidrofóbicas y algunas electrostáticas. Los ligandos del cobre y el zinc son seis cadenas laterales de histidina y una de aspartato; una histidina está unida entre los dos metales. Sitio activo para la dismutasa del superóxido de hierroIron o manganeso - utilizado por procariotas y protistas, y en mitocondrias y cloroplastos Hierro - Muchas bacterias contienen una forma de la enzima con hierro (Fe-SOD); algunas bacterias contienen Fe-SOD, otras Mn-SOD, y algunas (como ) contienen ambos.
Algunas declaraciones incorrectas conocidas sobre el análisis comparativo de siete tipos de superóxido...

Las estructuras tridimensionales de las superóxidos dismutasas homólogas de Mn y Fe tienen la misma disposición de los alfa-hélices, y sus sitios activos contienen el mismo tipo y disposición de cadenas laterales de aminoácidos. Normalmente son dímeros, pero ocasionalmente tetrámeros. Manganeso - Casi todas las mitocondrias, y muchas bacterias, contienen una forma con manganeso (Mn-SOD): Por ejemplo, el Mn-SOD que se encuentra en las mitocondrias humanas.
Níquel - procariótico. Tiene una estructura hexamérica (6 copias) construida a partir de haces de 4 hélices derechas, cada una de las cuales contiene ganchos N-terminales que quelan un ión de Ni. El Ni-gancho contiene el motivo His-Cys-X-X-Pro-Cys-Gly-X-Tyr; proporciona la mayoría de las interacciones críticas para la unión del metal y la catálisis y es, por lo tanto, un probable diagnóstico de las NiSOD. En las plantas superiores, las isozimas SOD se han localizado en diferentes compartimentos celulares.
La Fe-SOD se ha encontrado principalmente en cloroplastos pero también se ha detectado en peroxisomas, y el CuZn-SOD se ha localizado en citosol, cloroplastos, peroxisomas y apoplastos. Tres formas de superóxido dismutasa están presentes en los humanos, en todos los demás mamíferos y en la mayoría de las cuerdas. La SOD1 se encuentra en el citoplasma, la SOD2 en las mitocondrias, y la SOD3 es extracelular.
La Guía Definitiva de la Superoxidismutasa (Sod)
El SOD1 y el SOD3 contienen cobre y zinc, mientras que el SOD2, la enzima mitocondrial, tiene el manganeso en su centro reactivo. Los genes se encuentran en los cromosomas 21, 6 y 4, respectivamente (21q22.1, 6q25.3 y 4p15.3-p15.1). En las plantas superiores, las enzimas superóxido dismutasa (SOD) actúan como antioxidantes y protegen los componentes celulares de la oxidación por especies reactivas de oxígeno (ROS).
En concreto, el O2 molecular se reduce a O2- (un ROS llamado superóxido) cuando absorbe un electrón excitado liberado de los compuestos de la cadena de transporte de electrones. Se sabe que el superóxido desnaturaliza las enzimas, oxida los lípidos y fragmenta el ADN. Los SOD catalizan la producción de O2 y H2O2 a partir del superóxido (O2-), lo que resulta en reactivos menos dañinos.
La compartimentación de las diferentes formas de SOD en toda la planta hace que contrarresten el estrés de manera muy eficaz. Hay tres clases bien conocidas y estudiadas de coenzimas metálicas SOD que existen en las plantas. En primer lugar, las SOD de Fe consisten en dos especies, un homodímero (que contiene 1-2 g de Fe) y un tetrámero (que contiene 2-4 g de Fe).
La Brenda - Información sobre el Ec 1.15.1.1 - Ideas de la superóxido dismutasa
Los SOD de Fe se localizan más abundantemente dentro de los cloroplastos de las plantas, donde son autóctonos. En segundo lugar, los SOD de Mn consisten en una especie de homodímero y homotetrámero que contiene cada uno un solo átomo de Mn(III) por subunidad. Se encuentran predominantemente en la mitocondria y los peroxisomas. En tercer lugar, los SOD de Cu-Zn tienen propiedades eléctricas muy diferentes de las de las otras dos clases.
Obsérvese que los SOD de Cu-Zn proporcionan menos protección que los SOD de Fe cuando se localizan en el cloroplasto. Los glóbulos blancos humanos utilizan enzimas como la NADPH oxidasa para generar superóxido y otras especies de oxígeno reactivo para matar bacterias. Por lo tanto, durante la infección, algunas bacterias (por ejemplo, ) producen superóxido dismutasa para protegerse de ser eliminadas.
La reacción del superóxido con los no radicales está prohibida. En los sistemas biológicos, esto significa que sus principales reacciones son consigo mismo (dismutación) o con otro radical biológico como el óxido nítrico (NO) o con un metal de la serie de transición. El radical aniónico superóxido (O2-) se dismuta espontáneamente a O2 y peróxido de hidrógeno (H2O2) con bastante rapidez (~105 M-1s-1 a pH 7).[] La SOD es necesaria porque el superóxido reacciona con objetivos celulares sensibles y críticos.
Los hechos sobre la superóxido dismutasa del cobre y el zinc - Revelado por Proteopedia
Dado que la reacción de dismutación no catalizada para el superóxido requiere que dos moléculas de superóxido reaccionen entre sí, la tasa de dismutación es de segundo orden con respecto a la concentración inicial de superóxido. Así pues, la vida media del superóxido, aunque muy corta en concentraciones altas (por ejemplo, 0,05 segundos a 0,1mM) es en realidad bastante larga en concentraciones bajas (por ejemplo, 14 horas a 0,1 nM).
Además, la superóxido dismutasa tiene el mayor kcat/KM (una aproximación de la eficiencia catalítica) de todas las enzimas conocidas (~7 x 109 M-1s-1), estando esta reacción limitada sólo por la frecuencia de colisión entre ella y el superóxido. Es decir, la velocidad de reacción está "limitada por la difusión". La alta eficiencia de la superóxido dismutasa parece necesaria: incluso en las concentraciones subnanomolares alcanzadas por las altas concentraciones de SOD dentro de las células, el superóxido inactiva la enzima aconitasa del ciclo del ácido cítrico, puede envenenar el metabolismo energético y libera hierro potencialmente tóxico.
El SOD1 es una proteína extremadamente estable. En la forma holográfica (tanto el cobre como el zinc unidos) el punto de fusión es > 90 °C. En la forma apo (sin cobre ni zinc) el punto de fusión es de ~ 60 °C. Por calorimetría de barrido diferencial (DSC), la holo SOD1 se despliega por un mecanismo de dos estados: de dímeros a dos monómeros desplegados.
7 hechos fáciles sobre la superóxido dismutasa explicados

El superóxido es una de las principales especies reactivas de oxígeno en la célula. Como consecuencia, el SOD tiene un papel antioxidante clave. La importancia fisiológica de la SOD queda ilustrada por las graves patologías evidentes en los ratones diseñados genéticamente para carecer de estas enzimas. Los ratones que carecen de SOD2 mueren varios días después de nacer, en medio de un masivo estrés oxidativo.
Los ratones que carecen de SOD3 no muestran defectos obvios y exhiben una vida normal, aunque son más sensibles a las lesiones hiperóxicas. Los ratones que carecen de cualquier enzima SOD son más sensibles a los efectos letales de los compuestos generadores de superóxido, como el paraquat y el diquat (herbicidas). Los ratones que carecen de SOD1 tienen un período de vida dramáticamente acortado, mientras que las moscas que carecen de SOD2 mueren antes de nacer.