Faits concernant la superoxyde dismutase (Ransod) - Réactif - Randox dévoilé
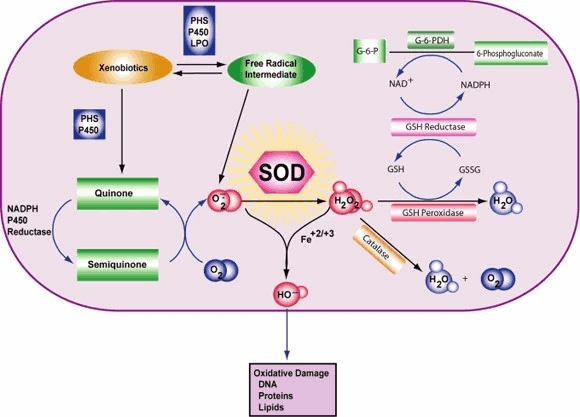
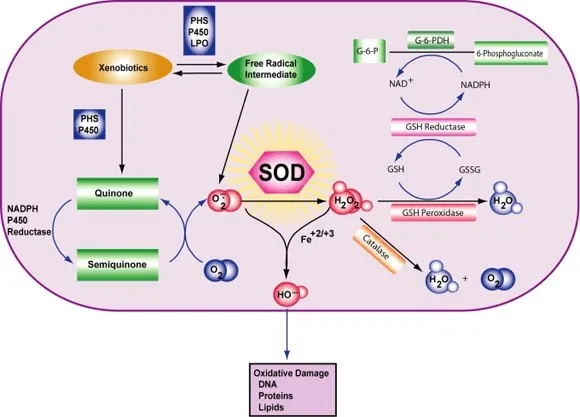
Classe d'enzymes La superoxyde dismutase (SOD, EC 1.15.1.1) est une enzyme qui catalyse alternativement la dismutation (ou partitionnement) du radical superoxyde (O2-) en oxygène moléculaire ordinaire (O2) et en peroxyde d'hydrogène (H2O2). Le superoxyde est produit comme sous-produit du métabolisme de l'oxygène et, s'il n'est pas régulé, provoque de nombreux types de dommages cellulaires.
Ainsi, la SOD est une importante défense antioxydante dans presque toutes les cellules vivantes exposées à l'oxygène. Les lactobacilles, qui utilisent un mécanisme différent pour prévenir les dommages causés par l'O2- réactif, font exception à cette règle. Les SOD catalysent la dismutation du superoxyde : 2 HO2 → O2 + H2O2 De cette façon, l'O2- est converti en deux espèces moins dommageables.
où M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2). Dans une série de ces réactions, l'état d'oxydation et la charge du cation métallique oscillent entre n et n+1 : +1 et +2 pour Cu, ou +2 et +3 pour les autres métaux . Irwin Fridovich et Joe McCord, de l'université de Duke, ont découvert l'activité enzymatique de la superoxyde dismutase en 1968.
Le buzz sur la molécule du mois : Superoxyde dismutase - Pdb-101
De même, Brewer (1967) a identifié une protéine, connue plus tard sous le nom de superoxyde dismutase, comme étant une indophénol oxydase, par l'analyse des protéines de gels d'amidon à l'aide de la technique de la phénazine-tétrazolium. Il existe trois grandes familles de superoxyde dismutase, en fonction du pli protéique et du cofacteur métallique : le type Cu/Zn (qui lie à la fois le cuivre et le zinc), les types Fe et Mn (qui lient soit le fer, soit le manganèse), et le type Ni (qui lie le nickel).
Les cytosols de pratiquement toutes les cellules eucaryotes contiennent une enzyme SOD avec du cuivre et du zinc (Cu-Zn-SOD). Par exemple, la Cu-Zn-SOD disponible dans le commerce est normalement purifiée à partir de globules rouges de bovins. L'enzyme Cu-Zn bovine est un homodimère d'un poids moléculaire de 32 500. C'est la première SOD dont la structure cristalline détaillée par atome a été résolue, en 1975.
Les deux sous-unités sont étroitement liées l'une à l'autre, principalement par des interactions hydrophobes et parfois électrostatiques. Les ligands du cuivre et du zinc sont six chaînes latérales d'histidine et une d'aspartate ; une histidine est liée entre les deux métaux. Site actif de la superoxyde dismutase de ferFer ou manganèse - utilisé par les procaryotes et les protistes, et dans les mitochondries et les chloroplastes Fer - De nombreuses bactéries contiennent une forme de l'enzyme avec le fer (Fe-SOD) ; certaines bactéries contiennent du Fe-SOD, d'autres du Mn-SOD, et certaines (comme ) contiennent les deux.
Quelques déclarations erronées connues sur l'analyse comparative de sept types de superoxyde ...

Les structures 3D des superoxydes dismutases homologues de Mn et de Fe ont le même arrangement d'hélices alpha, et leurs sites actifs contiennent le même type et le même arrangement de chaînes latérales d'acides aminés. Ce sont généralement des dimères, mais parfois des tétramères. Manganèse - Presque toutes les mitochondries, et de nombreuses bactéries, contiennent une forme avec du manganèse (Mn-SOD) : Par exemple, le Mn-SOD que l'on trouve dans les mitochondries humaines.
Nickel - procaryote. Il a une structure hexamérique (6 copies) construite à partir de faisceaux à 4 hélices droites, chacun contenant des crochets N-terminaux qui chélatent un ion Ni. Le crochet Ni-hook contient le motif His-Cys-X-X-Pro-Cys-Gly-X-Tyr ; il fournit la plupart des interactions critiques pour la liaison et la catalyse des métaux et constitue donc un diagnostic probable des NiSOD. Dans les plantes supérieures, les isozymes des SOD ont été localisées dans différents compartiments cellulaires.
Le Fe-SOD a été trouvé principalement dans les chloroplastes mais a également été détecté dans les peroxysomes, et le CuZn-SOD a été localisé dans le cytosol, les chloroplastes, les peroxysomes et l'apoplaste. Trois formes de superoxyde dismutase sont présentes chez l'homme, chez tous les autres mammifères et dans la plupart des chordates. La SOD1 est localisée dans le cytoplasme, la SOD2 dans les mitochondries, et la SOD3 est extracellulaire.
Le guide définitif de la superoxydésismutase (Sod)
Les SOD1 et SOD3 contiennent du cuivre et du zinc, tandis que la SOD2, l'enzyme mitochondriale, a du manganèse dans son centre réactif. Les gènes sont situés sur les chromosomes 21, 6 et 4, respectivement (21q22.1, 6q25.3 et 4p15.3-p15.1). Dans les plantes supérieures, les enzymes superoxyde dismutase (SOD) agissent comme antioxydants et protègent les composants cellulaires contre l'oxydation par les espèces réactives de l'oxygène (ROS).
Pour être précis, l'O2 moléculaire est réduit en O2- (un ROS appelé superoxyde) lorsqu'il absorbe un électron excité libéré par des composés de la chaîne de transport des électrons. Le superoxyde est connu pour dénaturer les enzymes, oxyder les lipides et fragmenter l'ADN. Les SOD catalysent la production d'O2 et de H2O2 à partir du superoxyde (O2-), ce qui permet d'obtenir des réactifs moins nocifs.
La compartimentation des différentes formes de SOD dans la plante leur permet de lutter très efficacement contre le stress. Il existe trois classes bien connues et étudiées de coenzymes métalliques de la SOD dans les plantes. Tout d'abord, les SOD de Fe se composent de deux espèces, un homodimère (contenant 1-2 g de Fe) et un tétramère (contenant 2-4 g de Fe).
The Brenda - Informations sur la CE 1.15.1.1 - Idées sur la superoxyde dismutase
Les SOD de Fe sont le plus souvent localisées à l'intérieur des chloroplastes végétaux, où elles sont indigènes. Deuxièmement, les SOD de Mn consistent en une espèce d'homodimère et d'homotétramère contenant chacune un seul atome de Mn(III) par sous-unité. On les trouve principalement dans les mitochondries et les peroxysomes. Troisièmement, les SOD Cu-Zn ont des propriétés électriques très différentes de celles des deux autres classes.
Notez que les SOD Cu-Zn offrent une protection moindre que les SOD Fe lorsqu'elles sont localisées dans le chloroplaste. Les globules blancs humains utilisent des enzymes telles que la NADPH oxydase pour générer du superoxyde et d'autres espèces réactives de l'oxygène afin de tuer les bactéries. Lors d'une infection, certaines bactéries (par exemple, ) produisent donc de la superoxyde dismutase pour se protéger de la mort.
La réaction du superoxyde avec les non-radicaux est bloquée par le spin. Dans les systèmes biologiques, cela signifie que ses principales réactions se font avec lui-même (dismutation) ou avec un autre radical biologique tel que l'oxyde nitrique (NO) ou avec un métal de la série des métaux de transition. Le radical anionique superoxyde (O2-) se dissocie spontanément en O2 et en peroxyde d'hydrogène (H2O2) assez rapidement (~105 M-1s-1 à pH 7) [] La SOD est nécessaire car le superoxyde réagit avec des cibles cellulaires sensibles et critiques.
Les faits sur le cuivre et le superoxyde de zinc dismutase - La protéopédie révélée
Comme la réaction de dismutation non catalysée du superoxyde nécessite que deux molécules de superoxyde réagissent entre elles, le taux de dismutation est de second ordre par rapport à la concentration initiale de superoxyde. Ainsi, la demi-vie du superoxyde, bien que très courte à des concentrations élevées (par exemple, 0,05 seconde à 0,1 mM) est en fait assez longue à de faibles concentrations (par exemple, 14 heures à 0,1 nM).
De plus, la superoxyde dismutase possède le plus grand kcat/KM (une approximation de l'efficacité catalytique) de toutes les enzymes connues (~7 x 109 M-1s-1), cette réaction n'étant limitée que par la fréquence de collision entre elle-même et le superoxyde. Autrement dit, la vitesse de réaction est "limitée par la diffusion". La grande efficacité de la superoxyde dismutase semble nécessaire : même aux concentrations subnanomolaires atteintes par les fortes concentrations de SOD dans les cellules, le superoxyde inactive l'aconitase, enzyme du cycle de l'acide citrique, peut empoisonner le métabolisme énergétique et libère du fer potentiellement toxique.
La SOD1 est une protéine extrêmement stable. Sous la forme holo (liée au cuivre et au zinc), le point de fusion est > 90 °C. Sous la forme apo (sans liaison au cuivre ou au zinc), le point de fusion est ~ 60 °C. Par calorimétrie différentielle à balayage (DSC), l'holo SOD1 se déploie par un mécanisme à deux états : du dimère à deux monomères dépliés.
7 Faits simples sur la superoxyde dismutase expliquée

Le superoxyde est l'une des principales espèces réactives de l'oxygène dans la cellule. En conséquence, la SOD joue un rôle antioxydant clé. L'importance physiologique des SOD est illustrée par les graves pathologies évidentes chez les souris génétiquement modifiées pour manquer de ces enzymes. Les souris dépourvues de SOD2 meurent plusieurs jours après leur naissance, dans un contexte de stress oxydatif massif.
Les souris dépourvues de SOD3 ne présentent aucun défaut évident et ont une durée de vie normale, bien qu'elles soient plus sensibles aux lésions hyperoxiques. Les souris knockout de toute enzyme SOD sont plus sensibles aux effets létaux des composés générateurs de superoxyde, tels que le paraquat et le diquat (herbicides). Les souris dépourvues de SOD1 ont une durée de vie considérablement réduite, tandis que les mouches dépourvues de SOD2 meurent avant la naissance.