Feiten over Superoxide Dismutase (Ransod) - Reagent - Randox Revealed
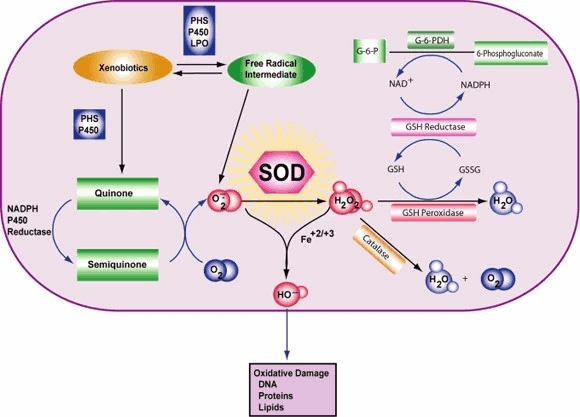
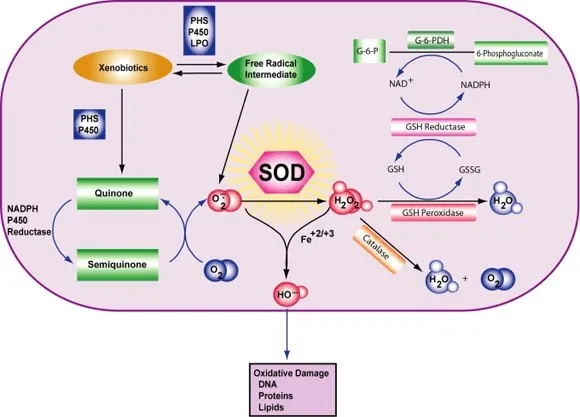
Klasse van enzymen Superoxide dismutase (SOD, EC 1.15.1.1) is een enzym dat afwisselend de dismutatie (of partitionering) van het superoxide (O2-) radicaal in gewone moleculaire zuurstof (O2) en waterstofperoxide (H2O2) katalyseert. Superoxide wordt geproduceerd als bijproduct van het zuurstofmetabolisme en veroorzaakt, indien niet gereguleerd, vele soorten celbeschadiging.
Zo is SOD een belangrijke antioxidant verdediging in bijna alle levende cellen die aan zuurstof worden blootgesteld. Een uitzondering is en aanverwante lactobacillen, die een ander mechanisme gebruiken om schade door reactieve O2- te voorkomen. SOD's katalyseren de onevenredigheid van superoxide: 2 HO2 → O2 + H2O2 Op deze manier wordt O2- omgezet in twee minder schadelijke soorten.
waarbij M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2). In een reeks van dergelijke reacties schommelt de oxidatietoestand en de lading van het metaalkation tussen n en n+1: +1 en +2 voor Cu, of +2 en +3 voor de andere metalen . Irwin Fridovich en Joe McCord aan de Duke University ontdekten in 1968 de enzymatische activiteit van superoxide dismutase.
The Buzz on Molecule Of The Month: Superoxide Dismutase - Pdb-101
Op dezelfde manier identificeerde Brewer (1967) een eiwit dat later bekend werd als superoxide dismutase als een indofenoloxidase door eiwitanalyse van zetmeelgels met behulp van de fenazine-tetrazolium techniek. Er zijn drie grote families van superoxide dismutase, afhankelijk van de eiwitvouw en de metalen cofactor: het Cu/Zn type (dat zowel koper als zink bindt), Fe en Mn types (die ijzer of mangaan binden), en het Ni type (dat nikkel bindt).
De cytosolen van vrijwel alle eukaryote cellen bevatten een SOD enzym met koper en zink (Cu-Zn-SOD). Bijvoorbeeld, Cu-Zn-SOD dat in de handel verkrijgbaar is, wordt normaal gesproken gezuiverd uit rode bloedcellen van runderen. Het runder-Cu-Zn enzym is een homodimer met een moleculair gewicht van 32.500. Het was het eerste SOD waarvan de atoomdetailkristalstructuur in 1975 werd opgelost.
De twee subeenheden zijn nauw met elkaar verbonden, meestal door hydrofobe en enkele elektrostatische interacties. De liganden van het koper en het zink zijn zes histidine en één aspartaatachtige zijketen; één histidine is gebonden tussen de twee metalen. Actieve site voor ijzer-superoxide dismutaseIron of mangaan - gebruikt door prokaryoten en protisten, en in mitochondriën en chloroplasten Ijzer - Veel bacteriën bevatten een vorm van het enzym met ijzer (Fe-SOD); sommige bacteriën bevatten Fe-SOD, andere Mn-SOD, en sommige (zoals ) bevatten beide.
Sommige bekende onjuiste verklaringen over vergelijkende analyse van zeven soorten superoxide ...

De 3D-structuren van de homologe Mn en Fe-superoxide dismutases hebben dezelfde rangschikking van alfa-helften en hun actieve sites bevatten hetzelfde type en dezelfde rangschikking van aminozuur-zijketens. Het zijn meestal dimmers, maar soms ook tetramers. Mangaan - Bijna alle mitochondriën en veel bacteriën bevatten een vorm met mangaan (Mn-SOD): Bijvoorbeeld, de Mn-SOD die in menselijke mitochondriën wordt gevonden.
Nikkel - prokaryotisch. Dit heeft een hexamerische (6-kopie) structuur opgebouwd uit rechtshandige 4-helixbundels, die elk N-terminale haken bevatten die een Ni-ion cheleren. De Ni-haak bevat het motief His-Cys-X-X-Pro-Cys-Gly-X-Tyr; het zorgt voor de meeste interacties die cruciaal zijn voor de metaalbinding en de katalyse en is daarom een waarschijnlijke diagnose van NiSODs. In hogere planten zijn SOD-isozymen gelokaliseerd in verschillende celcompartimenten.
Fe-SOD is voornamelijk gevonden in chloroplasten, maar is ook gedetecteerd in peroxisomen, en CuZn-SOD is gelokaliseerd in cytosol, chloroplasten, peroxisomen en apoplast. Drie vormen van superoxide dismutase zijn aanwezig in de mens, in alle andere zoogdieren en in de meeste chordaten. SOD1 bevindt zich in het cytoplasma, SOD2 in de mitochondriën, en SOD3 is extracellulair.
De Definitieve Gids voor Superoxidedismutase (Sod)
SOD1 en SOD3 bevatten koper en zink, terwijl SOD2, het mitochondriaal enzym, mangaan in zijn reactief centrum heeft. De genen bevinden zich op chromosomen 21, 6 en 4, respectievelijk (21q22.1, 6q25.3 en 4p15.3-p15.1). In hogere planten fungeren superoxide dismutase enzymen (SOD's) als antioxidanten en beschermen ze de cellulaire componenten tegen oxidatie door reactieve zuurstofsoorten (ROS).
Om specifiek te zijn, wordt moleculair O2 gereduceerd tot O2- (een ROS dat superoxide wordt genoemd) wanneer het een geëxciteerd elektron absorbeert dat vrijkomt uit verbindingen van de elektronentransportketen. Van superoxide is bekend dat het enzymen denatureert, lipiden oxideert en het DNA versplintert. SOD's katalyseren de productie van O2 en H2O2 uit superoxide (O2-), wat resulteert in minder schadelijke reactanten.
Door de compartimentering van de verschillende vormen van SOD in de hele plant worden ze zeer effectief tegen de stress aangepakt. Er zijn drie bekende en bestudeerde klassen van SOD metaalhoudende coenzymen die in planten voorkomen. Ten eerste bestaat Fe SOD uit twee soorten, een homodimer (met 1-2 g Fe) en een tetramer (met 2-4 g Fe).
De Brenda - Informatie over Ec 1.15.1.1 - Superoxide Dismutase Ideeën
Fe SODs zijn het meest overvloedig gelokaliseerd in plantaardige chloroplasten, waar ze inheems zijn. Ten tweede bestaan Mn ZODE's uit een homodimer en homotetramer soort die elk één Mn(III) atoom per subeenheid bevatten. Ze komen voornamelijk voor in mitochondriën en peroxisomen. Ten derde hebben Cu-Zn SOD's elektrische eigenschappen die sterk verschillen van die van de andere twee klassen.
Merk op dat Cu-Zn SODs minder bescherming bieden dan Fe SODs wanneer ze gelokaliseerd zijn in de chloroplast. Menselijke witte bloedcellen gebruiken enzymen zoals NADPH-oxidase om superoxide te genereren en andere reactieve zuurstofsoorten om bacteriën te doden. Tijdens de infectie produceren sommige bacteriën (bijv. ) daarom superoxide dismutase om zichzelf te beschermen tegen de dood.
De reactie van superoxide met niet-radicalen is spin-forbide. In biologische systemen betekent dit dat de belangrijkste reacties met zichzelf (ontleding) of met een andere biologische radicaal zoals stikstofoxide (NO) of met een metaal uit de overgangsserie zijn. De superoxide anionradicaal (O2-) ontkoppelt zich spontaan van O2 en waterstofperoxide (H2O2) vrij snel (~105 M-1s-1 bij pH 7).[] SOD is nodig omdat superoxide reageert met gevoelige en kritische cellulaire doelwitten.
De feiten over Koper, Zink Superoxide Dismutase - Proteopedia Revealed
Omdat de ongekatalyseerde ontmantelingsreactie voor superoxide twee superoxide moleculen nodig heeft om met elkaar te reageren, is de ontmantelingssnelheid tweede orde ten opzichte van de oorspronkelijke superoxideconcentratie. De halfwaardetijd van superoxide, hoewel zeer kort bij hoge concentraties (bijv. 0,05 seconden bij 0,1 mM), is dus eigenlijk vrij lang bij lage concentraties (bijv. 14 uur bij 0,1 nM).
Bovendien heeft superoxide dismutase de grootste kcat/KM (een benadering van de katalytische efficiëntie) van alle bekende enzymen (~7 x 109 M-1s-1), waarbij deze reactie alleen wordt beperkt door de frequentie van de botsing tussen zichzelf en superoxide. Dat wil zeggen, de reactiesnelheid is "diffusielimiet". Het hoge rendement van superoxide dismutase lijkt noodzakelijk: zelfs bij de subnanomolaire concentraties die door de hoge concentraties SOD in de cellen worden bereikt, inactiveert superoxide het enzym aconitase van de citroenzuurcyclus, kan het energiemetabolisme vergiftigen en komt potentieel giftig ijzer vrij.
SOD1 is een uiterst stabiel eiwit. In de holovorm (zowel koper als zink gebonden) is het smeltpunt > 90 °C. In de apo-vorm (geen koper- of zinkbinding) is het smeltpunt ~ 60 °C. Door differentiële scanning calorimetrie (DSC) ontvouwt holo SOD1 zich door een twee-staten-mechanisme: van dimmer naar twee ontvouwde monomeren.
7 Gemakkelijke feiten over Superoxide Dismutase uitgelegd

Superoxide is een van de belangrijkste reactieve zuurstofsoorten in de cel. Als gevolg daarvan heeft SOD een belangrijke antioxidante rol. Het fysiologische belang van SOD's wordt geïllustreerd door de ernstige pathologieën die bij muizen voorkomen die genetisch gemanipuleerd zijn om deze enzymen te missen. Muizen zonder SOD2 sterven enkele dagen na de geboorte, te midden van massale oxidatieve stress.
Muizen zonder SOD3 vertonen geen duidelijke gebreken en hebben een normale levensduur, hoewel ze gevoeliger zijn voor hyperoxisch letsel. Knock-out muizen van een SOD-enzym zijn gevoeliger voor de dodelijke effecten van superoxide-genererende verbindingen, zoals paraquat en diquat (herbiciden). muizen zonder SOD1 hebben een dramatisch kortere levensduur, terwijl vliegen zonder SOD2 sterven voor de geboorte.