Fakten über Superoxid-Dismutase (Ransod) - Reagenz - Randox Revealed
Enzymklasse Superoxiddismutase (SOD, EC 1.15.1.1) ist ein Enzym, das abwechselnd die Dismutation (oder Aufspaltung) des Superoxid-(O2-)Radikals in gewöhnlichen molekularen Sauerstoff (O2) und Wasserstoffperoxid (H2O2) katalysiert. Superoxid wird als Nebenprodukt des Sauerstoffstoffwechsels produziert und verursacht, wenn es nicht reguliert wird, viele Arten von Zellschäden.
Somit ist SOD ein wichtiger antioxidativer Schutz in fast allen lebenden Zellen, die Sauerstoff ausgesetzt sind. Eine Ausnahme bilden SOD und verwandte Laktobazillen, die einen anderen Mechanismus nutzen, um Schäden durch reaktives O2 zu verhindern. SODs katalysieren die Disproportionierung von Superoxid: 2 HO2 → O2 + H2O2 Auf diese Weise wird O2- in zwei weniger schädliche Spezies umgewandelt.
wobei M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2). In einer Reihe solcher Reaktionen oszilliert die Oxidationsstufe und die Ladung des Metallkations zwischen n und n+1: +1 und +2 für Cu, oder +2 und +3 für die anderen Metalle . Irwin Fridovich und Joe McCord an der Duke University entdeckten 1968 die enzymatische Aktivität der Superoxid-Dismutase.
Der Buzz auf Molekül des Monats: Superoxid-Dismutase - Pdb-101
Ebenso identifizierte Brewer (1967) ein Protein, das später als Superoxid-Dismutase bekannt wurde, als eine Indophenol-Oxidase durch Proteinanalyse von Stärkegelen mit der Phenazin-Tetrazolium-Technik. Es gibt drei Hauptfamilien der Superoxiddismutase, abhängig von der Proteinfaltung und dem Metall-Cofaktor: den Cu/Zn-Typ (der sowohl Kupfer als auch Zink bindet), Fe- und Mn-Typen (die entweder Eisen oder Mangan binden) und den Ni-Typ (der Nickel bindet).
Die Zytosole praktisch aller eukaryotischen Zellen enthalten ein SOD-Enzym mit Kupfer und Zink (Cu-Zn-SOD). Kommerziell erhältliches Cu-Zn-SOD wird z. B. normalerweise aus bovinen roten Blutkörperchen gereinigt. Das bovine Cu-Zn-Enzym ist ein Homodimer mit einem Molekulargewicht von 32.500. Es war das erste SOD, dessen Kristallstruktur im atomaren Detail gelöst wurde, und zwar im Jahr 1975.
Die beiden Untereinheiten sind eng Rücken an Rücken miteinander verbunden, hauptsächlich durch hydrophobe und einige elektrostatische Wechselwirkungen. Die Liganden des Kupfers und Zinks sind sechs Histidin- und eine Aspartat-Seitenkette; ein Histidin ist zwischen den beiden Metallen gebunden. Aktive Stelle für Eisen-SuperoxiddismutaseEisen oder Mangan - wird von Prokaryoten und Protisten sowie in Mitochondrien und Chloroplasten verwendet Eisen - Viele Bakterien enthalten eine Form des Enzyms mit Eisen (Fe-SOD); einige Bakterien enthalten Fe-SOD, andere Mn-SOD, und einige (wie ) enthalten beides.
Einige bekannte falsche Aussagen über die vergleichende Analyse von sieben Arten von Superoxiden ...

Die 3D-Strukturen der homologen Mn- und Fe-Superoxiddismutasen haben die gleiche Anordnung von alpha-Helices, und ihre aktiven Stellen enthalten die gleiche Art und Anordnung von Aminosäure-Seitenketten. Sie sind normalerweise Dimere, gelegentlich aber auch Tetramere. Mangan - Fast alle Mitochondrien, und viele Bakterien, enthalten eine Form mit Mangan (Mn-SOD): Zum Beispiel das in menschlichen Mitochondrien vorkommende Mn-SOD.
Nickel - prokaryotisch. Diese hat eine hexamere (6-Kopien) Struktur, die aus rechtshändigen 4-Helix-Bündeln aufgebaut ist, die jeweils N-terminale Haken enthalten, die ein Ni-Ion chelatisieren. Der Ni-Haken enthält das Motiv His-Cys-X-X-Pro-Cys-Gly-X-Tyr; es stellt die meisten der für die Metallbindung und Katalyse kritischen Interaktionen bereit und ist daher ein wahrscheinliches Diagnostikum von NiSODs. In höheren Pflanzen wurden die SOD-Isoenzyme in verschiedenen Zellkompartimenten lokalisiert.
Fe-SOD wurde hauptsächlich in Chloroplasten gefunden, wurde aber auch in Peroxisomen nachgewiesen, und CuZn-SOD wurde im Cytosol, in Chloroplasten, Peroxisomen und im Apoplast lokalisiert. Drei Formen der Superoxid-Dismutase sind beim Menschen, bei allen anderen Säugetieren und den meisten Chordaten vorhanden. SOD1 befindet sich im Zytoplasma, SOD2 in den Mitochondrien, und SOD3 ist extrazellulär.
Der definitive Leitfaden für Superoxidedismutase (Sod)
SOD1 und SOD3 enthalten Kupfer und Zink, während SOD2, das mitochondriale Enzym, Mangan in seinem reaktiven Zentrum hat. Die Gene befinden sich auf den Chromosomen 21, 6 bzw. 4 (21q22.1, 6q25.3 und 4p15.3-p15.1). In höheren Pflanzen wirken Superoxiddismutase-Enzyme (SODs) als Antioxidantien und schützen zelluläre Komponenten vor der Oxidation durch reaktive Sauerstoffspezies (ROS).
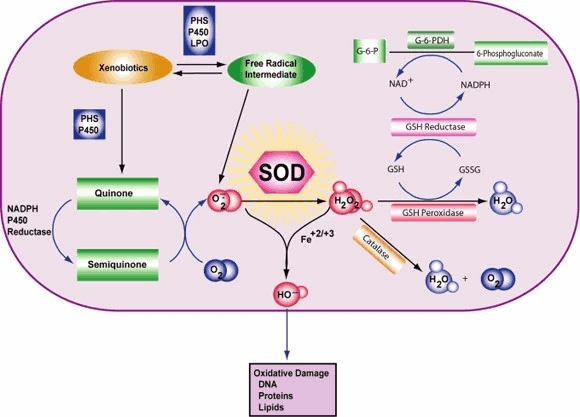
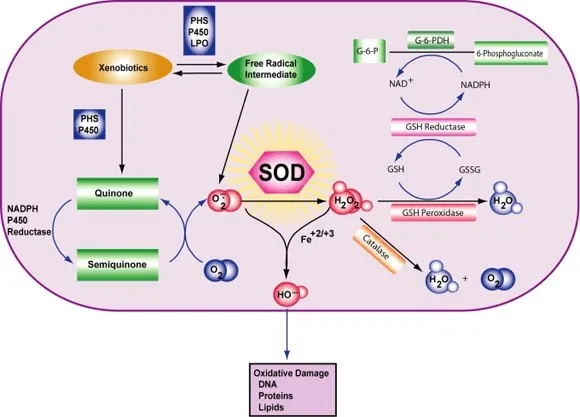
Um genau zu sein, wird molekulares O2 zu O2- (ein ROS, das Superoxid genannt wird) reduziert, wenn es ein angeregtes Elektron absorbiert, das von Verbindungen der Elektronentransportkette abgegeben wird. Superoxid ist bekannt dafür, Enzyme zu denaturieren, Lipide zu oxidieren und DNA zu fragmentieren. SODs katalysieren die Produktion von O2 und H2O2 aus Superoxid (O2-), was zu weniger schädlichen Reaktanten führt.
Durch die Kompartimentierung verschiedener Formen von SOD in der Pflanze wirken sie Stress sehr effektiv entgegen. Es gibt drei bekannte und untersuchte Klassen von SOD-Metall-Coenzymen, die in Pflanzen existieren. Erstens, Fe-SODs bestehen aus zwei Spezies, einem Homodimer (mit 1-2 g Fe) und einem Tetramer (mit 2-4 g Fe).
Die Brenda - Informationen zu Ec 1.15.1.1 - Superoxid-Dismutase Ideen
Fe-SODs sind am häufigsten in den Chloroplasten von Pflanzen lokalisiert, wo sie heimisch sind. Zweitens bestehen Mn-SODs aus einer Homodimer- und Homotetramer-Spezies, die jeweils ein einzelnes Mn(III)-Atom pro Untereinheit enthalten. Sie sind vorwiegend im Mitochondrium und in Peroxisomen zu finden. Drittens haben Cu-Zn-SODs elektrische Eigenschaften, die sich stark von denen der anderen beiden Klassen unterscheiden.
Beachten Sie, dass Cu-Zn-SODs weniger Schutz bieten als Fe-SODs, wenn sie im Chloroplasten lokalisiert sind. Die menschlichen weißen Blutkörperchen verwenden Enzyme wie die NADPH-Oxidase, um Superoxid und andere reaktive Sauerstoffspezies zu erzeugen, um Bakterien abzutöten. Während einer Infektion produzieren einige Bakterien (z. B. ) daher Superoxiddismutase, um sich vor ihrer Abtötung zu schützen.
Die Reaktion des Superoxids mit Nicht-Radikalen ist spin-verboten. In biologischen Systemen bedeutet dies, dass seine Hauptreaktionen mit sich selbst (Dismutation) oder mit einem anderen biologischen Radikal wie Stickstoffmonoxid (NO) oder mit einem Metall der Übergangsreihe erfolgen. Das Superoxid-Anion-Radikal (O2-) zerfällt spontan zu O2 und Wasserstoffperoxid (H2O2) recht schnell (~105 M-1s-1 bei pH 7).[] SOD ist notwendig, weil Superoxid mit empfindlichen und kritischen zellulären Zielen reagiert.
Die Fakten über Kupfer, Zink Superoxid-Dismutase - Proteopedia aufgedeckt
Da die unkatalysierte Dismutationsreaktion für Superoxid zwei Superoxidmoleküle erfordert, um miteinander zu reagieren, ist die Dismutationsrate zweiter Ordnung in Bezug auf die anfängliche Superoxidkonzentration. Daher ist die Halbwertszeit von Superoxid, obwohl sie bei hohen Konzentrationen sehr kurz ist (z. B. 0,05 Sekunden bei 0,1 mM), bei niedrigen Konzentrationen tatsächlich recht lang (z. B. 14 Stunden bei 0,1 nM).
Darüber hinaus hat die Superoxid-Dismutase die größte kcat/KM (eine Annäherung an die katalytische Effizienz) aller bekannten Enzyme (~7 x 109 M-1s-1), wobei diese Reaktion nur durch die Häufigkeit der Kollision zwischen ihr und dem Superoxid begrenzt wird. Das heißt, die Reaktionsgeschwindigkeit ist "diffusionslimitiert". Die hohe Effizienz der Superoxid-Dismutase scheint notwendig zu sein: Selbst bei den subnanomolaren Konzentrationen, die durch die hohen Konzentrationen von SOD in den Zellen erreicht werden, inaktiviert Superoxid das Zitronensäurezyklus-Enzym Aconitase, kann den Energiestoffwechsel vergiften und setzt potenziell toxisches Eisen frei.
SOD1 ist ein extrem stabiles Protein. In der Holo-Form (sowohl Kupfer als auch Zink gebunden) liegt der Schmelzpunkt bei > 90 °C. In der apo-Form (kein Kupfer oder Zink gebunden) liegt der Schmelzpunkt bei ~ 60 °C. Durch Differential-Scanning-Kalorimetrie (DSC) entfaltet sich holo SOD1 durch einen Zwei-Zustands-Mechanismus: vom Dimer zu zwei entfalteten Monomeren.
7 einfache Fakten über Superoxid-Dismutase erklärt

Superoxid ist eine der wichtigsten reaktiven Sauerstoffspezies in der Zelle. Infolgedessen hat SOD eine wichtige antioxidative Funktion. Die physiologische Bedeutung von SODs wird durch die schweren Pathologien veranschaulicht, die bei Mäusen auftreten, denen diese Enzyme genetisch fehlen. Mäuse, denen SOD2 fehlt, sterben einige Tage nach der Geburt inmitten von massivem oxidativem Stress.
Mäuse, denen SOD3 fehlt, zeigen keine offensichtlichen Defekte und weisen eine normale Lebensspanne auf, sind aber empfindlicher gegenüber hyperoxischen Schädigungen. Knockout-Mäuse, denen ein beliebiges SOD-Enzym fehlt, sind empfindlicher gegenüber den tödlichen Auswirkungen von Superoxid-erzeugenden Verbindungen wie Paraquat und Diquat (Herbizide). Fliegen, denen SOD1 fehlt, haben eine dramatisch verkürzte Lebensspanne, während Fliegen, denen SOD2 fehlt, vor der Geburt sterben.